隨著新型冠狀病毒疫苗的推出,人工智能(Artificial Intelligence,AI)在藥物研發中越發不可或缺。目前,國內外學者、研究院已經廣泛開展人工智能技術用于新冠疫苗研發的研究,因為AI平臺可以通過大數據處理、機器學習等技術對有效控制SARS-CoV,SARS-CoV-2和HIV病毒的化合物進行分析利用,從而鑒定具有抑制人類冠狀病毒活性的藥物。人工智能作為新一代信息技術,也將成為在我國“十四五”期間為推動經濟發展,助力疾病醫治預測,創新藥物、醫療器械研發應用的核心驅動力之一。
1. 人工智能的概念
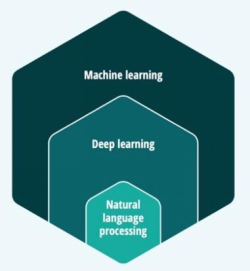
人工智能這個概念已經不再陌生,通常是指通過計算機程序或者系統來呈現人類思維和智能的技術。人工智能通過抓取數據中存在的概念和關系,獨立分析學習數據模式從而達到模擬人類思維的目的。人工智能主要涉及的方法領域包括推理、知識表達、搜索解決方案以及機器學習(Machine Learning)。
德勤咨詢報告將機器學習劃分為廣義的人工智能技術,并定義為“從結構化和非結構化數據中學習、識別隱藏模式、進行分類并預測未來結果的計算機算法。”機器學習技術包括深度學習(Deep Learning),是一種基于機器學習的方法,利用一種類似于大腦的邏輯結構(稱為神經“網絡”),來識別和區分語音、圖像和視頻等模式。自然語言處理(Natural language processing,NLP)是深度學習的一種,是計算機技術在自然語言和語音分析與合成中的應用。
2. AI在新藥研發中的具體應用
新藥研發是個漫長而復雜的過程,伴隨著高昂的研發成本、精力以及高度不確定性。有學者統計,一個新藥從研發初期到上市,可能需要數十年,消耗資金可多達30億美元。典型的新藥研發過程通常包括:1)早期的目標識別及靶點、最優化合物確認;2)臨床前研究;3)臨床研究I、II、III期階段;以及4)食藥監局審批。在化學世界里,潛在藥物分子多達1060個,因此發現新藥可以說如同大海撈針。近年來,傳統的新藥研發越來越難,研發投資和研發時間也不斷增加。新藥研發處于一個難以突破的瓶頸階段,急需借助于新的技術來幫助新藥研發的不斷突破。
人工智能憑借其強大的自適應特征和學習能力,通過算法、推演等技術核心可以應用到新藥研發的各個環節,在保證分析質量的同時,可實現大幅降低藥物研發成本, 縮短研發時間,提高研發效率,使新藥開發走上快速高效的道路。
Tekade博士及其團隊于2020在《Drug Discovery Today》期刊上發表的一篇文獻里總結到人工智能技術在新藥研發的五個重要部分都有不可估量的潛力:

下面從這幾個AI在醫藥行業實際應用的領域作詳細的介紹:
(1) 藥物設計
預測靶點蛋白3D結構
蛋白質功能紊亂是導致許多疾病的重要因素,因此在新藥研發第一步靶點識別和確認中,找到藥物在體內的作用靶點,確定靶點蛋白質結構從而針對性設計藥物分子來調節蛋白功能是至關重要的基石。蛋白質的三維結構由一系列氨基酸折疊而成,由于根據最穩態原理推測出蛋白質三維結構需要考慮到其各個原子間的相互作用力,因此巨大的計算量使得測定蛋白質結構往往需要很長的周期、經費且難度大。
到目前為止,在“生命體中已知的約2億種氨基酸序列中,只有約17萬種蛋白質結構得以確定”。盡管如此,對于已經存在大量數據的氨基酸序列,人工智能已經被研究學者用于預測蛋白質結構。Spencer等人在2015年通過采用deep learning network architectures(DNSS)對198個蛋白質進行完全獨立測試,預測第二級蛋白質結構準確率達到了80.7%。Wang博士及其團隊在2016年發表于《自然》的文獻里介紹到一種叫DeepCNF(Deep Convolutional Neutral Fields)的人工智能技術用于預測蛋白質的第二級結構。DeepCNF技術不僅可以通過深度層次結構對復雜的序列與結構關系建模,還可以對相鄰的蛋白質第二級結構標簽之間的相互依賴性進行建模。實驗結果證明該技術可實現84%的預測準確率,并可以擴展到對蛋白質的其他結構性質,比如接觸數、無序區域以及溶劑可及性。去年11月30日,谷歌旗下的DeepMind公司AlphaFold人工智能系統在國際蛋白質結構預測競賽(Critical Assessment of Structure Prediction,CASP)上以絕對的優勢奪冠,其預測的蛋白質三維結構與實驗方法解析的結構幾乎完全吻合,在最具挑戰的蛋白質結構預測上也獲得將近90分的成績,而其他參賽隊伍最好的成績也只有75分。由此可見,人工智能技術在實現蛋白質結構的精準預測有巨大潛力,將會為新藥研發帶來前所未有的技術革新從而提高研發效率。
預測藥物和蛋白質相互作用
決定藥物的靶蛋白,也被稱作藥物和蛋白質的相互作用(drug-protein interaction,DPI),在藥物研發過程中有著極其重要的作用:通過預測藥物與受體或者蛋白質的相互作用,可以幫助理解藥物的功效、效力,從而對藥物進行最有效的設計。
得益于越發豐富的數據庫(例如化合物集中的數據庫PubChem、ChEMBL以及DUD-E,蛋白質集中的數據庫UniProt和PDBbind以及整合數據庫BindingDB)許多研究學者已經采用不同的人工智能技術對配基-蛋白質的相互作用成功進行預測。Wang博士等人采用Support Vector Machine(SVM,一種按監督學習的方式對數據進行二向分類的廣義線性分類器),對存在于626個蛋白質和10000個活躍化合物里15000個配基-蛋白質的相互作用進行訓練,成功地發現了4種重要藥理靶點(GPR4,SIRT1,p38,and GSK-3β)的9種新型活性化合物。
(2) 化學合成
新藥研發高成本很大一部分可能歸因于兩個因素:經過臨床試驗的候選分子的高損耗率(損耗率超過85%)和前一個研發階段的復雜性,這需要大量的時間和資源投資。如果一家制藥公司擁有更強大的臨床前候選藥物管道,這將在藥物總批準方面產生有益的下游效應。因此,采用先進的計算機硬件和計算機方法加快以及提高藥物化學在藥物新藥發現循環下各個方面的表現-design-make-test-analyze (DMTA)。這其中,研究學者越來越感興趣的一個領域是使用數據驅動合成預測工具使階段加速和減少新分子實體合成的失敗。
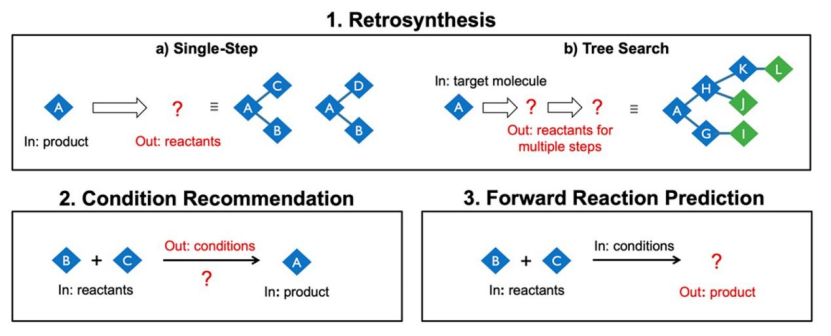
計算機輔助化學合成綜合規劃的三個主要任務包括:
(1)逆合成可以分解為以下問題:
(a)每次一步生成反合成建議和
(b)遞歸使用單步建議來識別完整的多步路線。
(2)為了使建議可行,必須提出能導致成功正向反應的反應條件。
(3)反應預測,從一組起始原料和條件預測可能的產物,用于驗證所提出的合成步驟。
(3) 藥物再利用
藥物再利用或者藥物再定位(drug repurposing)指將已上市的藥物,包括正在進行研究的藥物和臨床失敗的藥物,用于原定用途之外的疾病治療的過程。正如諾貝爾獎獲得者藥理學家Sir James Black的一句名言所說: “發現新藥最富有成效的基礎就是老藥(The most fruitful basis of the discovery of a new drug is to start with an old drug)”。得益于老藥已知的安全性,藥物再利用不僅可以大幅度降低研發成本,還可以有效減少藥物安全性測試的相關的風險,因此也是新藥研發中比較重要的一種研發策略。
如今,人工智能技術已經被廣泛用于藥物再利用的系統研發過程中。Steve Rodriguez 和他的團隊開發的機器學習框架-DRIAD (Drug Repurposing in AD)能夠量化阿爾茲海默癥的嚴重程度(Braak階段)的病理和分子機制之間的潛在聯系,該研究通過對80種主要含抗癌活性的激酶抑制劑(其中33種已經FDA批準并經臨床測試)進行體外分析,將DRIAD用于分析由這80種化合物產生的基因列表,產生一個可能的再利用候選藥物的排名列表。 DRIAD需要兩類輸入信息進行學習 – 阿爾茲海默癥不同發展階段人類大腦的mRNA表達情況以及由神經元細胞差異表達的基因組成的序列。由于在進行模型訓練和預測評估之前,DRIAD就已經分離出基因表達富集與預測性能,因此該人工智能框架能夠提供更直接、更客觀的量化結果。
Zhou Yadi博士等人在《柳葉刀》發表的一篇文獻中總結到不同人工智能技術用于藥物再利用的研究,尤其將老藥用于新冠肺炎(COVID-19)的治療的可能性。這些技術包括前饋神經網絡(Feedforward Neural Network)、主要分析處理圖像輸入變量的卷積神經網絡(Convolutional Neural Network),更適合處理生物序列的循環神經網絡(Recurrent neural networks)以及圖表表征學習(Graph representation learning)。通過人工智能技術(藥物網絡分析)發現可能用于新冠肺炎治療的候選藥物包括托瑞米芬(Toremifene),一款于1997年被批準用于治療乳腺癌的第一代雌激素受體調節劑。體外實驗表明,托瑞米芬在微摩爾濃度下可阻斷病毒感染,包括中東呼吸綜合征冠狀病毒、新型冠狀病毒SARS-CoV-2。經過Benevolent AI公司的知識網絡圖譜分析與識別,巴瑞替尼(Baricitinib)也被認為對治療新冠肺炎的有一定功效。目前,至少2項以巴瑞替尼單獨或與抗病毒藥物聯合治療的用于中度和重度的新冠肺炎患者的雙盲試驗臨床II期正在美國進行。
(4) 多重藥理學
在現代藥物研發領域,大多數治療方法都是通過調節多個靶標和通路來達到預期效果。根據美國國家醫學圖書館的定義,多重藥理學是“對作用于多個靶點或疾病途徑的藥劑的設計或使用”。如癌癥、阿爾茨海默癥等復雜疾病通常由環境、遺傳等多種因素共用作用的復雜機制引起的。因此,多重藥理學已經被提出并成為一種強大和有前途的替代范式,用于開發多種治療藥物,以滿足迫切的醫療求。
雖然在過去多靶點藥物的鑒定主要是偶然的,隨著化學生物學和計算機科學的發展,使藥物多重藥理學的合理設計成為可能。特別是,現代體外高通量/高含量篩選和體內動物模型技術加快了對藥物靶點組合的系統識別,而在電腦模擬(in silico)方法中,結構體學和藥物化學使多靶點藥物的有效設計成為可能。
基于配體的藥物多藥理學預測方法主要依賴于其化學結構和生物活性。最近,Lee等利用1121個靶點,利用人工智能隨機森林方法開發了基于配體的靶點預測模型。結果顯示,對于前1%和前3%的目標,他們的回憶率分別達到了67.6%和73.9%。
總部位于加拿大多倫多的生物科技公司Cyclica專門采用多藥理學方法進行藥物發現,將藥物分子的所有潛在靶標相互作用作為首要考慮因素。Cyclica的集成人工智能(AI)增強藥物發現平臺能夠對具有良好多重藥理特征和藥用特性的候選藥物進行多目標評估和設計。不同于傳統計算機輔助藥物設計的方法(如側重于基于結構的生物物理學以及基于知識)需要在有大量數據存在的分子類別和蛋白質靶標上發揮最大作用,Cylica的平臺促進了針對特征不太明確的蛋白質的分子設計,同時也揭示了分子的作用機制。Cyclica平臺將目標反褶積應用于藥物再利用和重新設計。該平臺由兩個機器學習引擎MatchMaker和POEM提供動力。
(5) 藥物篩選
虛擬篩選(virtual screening)是計算機輔助藥物設計中一種重要的開發工具。利用小分子化合物與藥物靶點間的分子對接運算,虛擬篩選可以從龐大的分子中快速遴選出活性化合物。傳統的高通量篩選技術(High-throughput screening)存在高成本、低成功率的問題,虛擬篩選則可通過在早期藥物研發時過濾掉結構不合適的化合物,提高化合物篩選效率,從而縮短研究周期,降低藥物研發的成本。
虛擬篩選主要的兩種方法有基于配體的虛擬篩選(ligand-based virtual screening,LBVS)與基于受體的虛擬篩選(structure-based virtual screening,SBVS)。前者不依賴三維蛋白質結構信息,而是基于活性及非活性配體的實證數據,利用活性配體之間的化學和空間相似性及物理化學分析來預測和識別其他具有高生物活性的配體。傳統的機器學習方法,例如SVM、KNN、Boosting以及NB,被大量運用在LBVS中。而SBVS則依賴于實驗測定的或同源模建的受體生物大分子的三維結構,主要用于研究可能的活性配體與結合為點殘基間的相互作用。 SBVS通過打分函數對蛋白和小分子化合物的結合能力進行評價,最終從大量的化合物分子中挑選出結合模式比較合理的、預測得分較高的化合物,往往比LBVS有更好的預測表現。
3. AI在實際藥物研發中的成功案例
截止2021年四月十二日,據BiopharmaTrend.com網站統計,專注人工智能技術進行藥物開發與研究的公司已達到270家,分散于10個不同領域,包括化學合成、靶點/先導化合物確認、臨床前研究、藥物再利用等。
人工智能公司與國際大型藥企的合作已經屢見不鮮,許多國際大藥企就不同藥物研發領域同人工智能公司展開相應的戰略合作。GlaxoSmithKline (GSK)在2017年同美國的Insilico Medicine達成合作協議,希望借助后者的人工智能平臺發現新的藥物靶點及通路。2017年6月,Genentech宣布與GNS Healthcare進行研究合作,利用該公司自有的REFS機器學習和模擬AI平臺去識別與驗證新的癌癥藥物靶點。武田制藥也宣布同人工智能藥物設計公司Numerate進行多年研究合作,專注開發腫瘤學、胃腸病學和中樞神經系統疾病的新臨床候選藥物。本篇文章重點介紹兩家人工智能公司Exscientia和BenevolentAI,及其人工智能技術在藥物研發中已經取得的一些成果。
Exscientia
Exscientia是一家位于英國牛津,通過端對端的人工智能平臺對藥物進行設計制藥科技公司,也是首家實現藥物設計自動化的公司。許多國際大藥企已經分別與Exscientia達成戰略合作:2017,GSK與Exscientia簽署研究協議就GSK篩選的10個疾病靶點通過人工智能平臺開發小分子藥物,并且針對這些靶點發現臨床候選藥,如果所有里程碑Exscientia都實現,則會獲得GSK提供的3300萬英鎊的研究資金。同年,賽諾菲出資2.73億美元,與Exscientia共同開發治療糖尿病及其并發癥的雙特異小分子藥物,涉及領域包括血糖控制、非酒精性脂肪肝、體重管理及其他代謝方面的疾病。雙方已經篩選了45個單靶點和1000個雙靶點組合,隨后會借助Exscientia的人工智能平臺剔除掉在化學上難以處理的組合。拜耳和Exscientia于2020年初簽署一份為期三年價值2.4億歐元的合作協議,通過結合Exscientia的人工智能藥物研發平臺以及拜耳的數據,專注藥物早期研究、識別及優化治療心血管疾病和腫瘤疾病的先導化合物。
許多與Exscientia合作的制藥公司在新藥研發方面已經取得了一些進展。2020年1月30日,日本住友制藥協會與Exscientia合作開發的首個AI設計的新藥,用于治療強迫癥的DSP-1181已經在日本開展I期臨床試驗。該藥物的設計借助于住友制藥在G蛋白偶聯受體方面的藥物研發經驗以及Exscientia的Centaur Chemist?人工智能平臺,將探索性研究所需時間大幅縮短至12個月以內,而用傳統辦法進行的研究平均則需4.5年。2021年4月9日,Exscientia宣布與Evotec共同合作研發的由AI設計的腫瘤免疫分子即將進入臨床試驗。該腫瘤免疫分子是一款A2A受體拮抗劑(EXS21546),用于治療成人晚期實體瘤,通過研究EXS21546證明了A2A受體的活性足以在高濃度腺苷類似物存在的情況下完全恢復T細胞功能。此外,Exscientia的CEO Andrew Hopkins博士還表示“盡管我們為這個項目設立了具有挑戰性的目標-對A2A受體的高選擇性和中樞神經系統保留特性從而減少全身副作用,還是可以在項目啟動后的8個月內發現候選藥物分子。”
Benevolent AI
Benevolent AI是一家成立于英國倫敦的獨角獸公司,其主要利用人工智能技術,從各種結構化以及非結構化的生物醫學數據源中提取數據并整理、歸納、標準化,通過將數據輸入到公司的專利知識圖譜中,從而提取出能夠推動藥物研發的知識而加速藥物研發的過程。
阿斯利康與Benevolent AI于2019年達成戰略合作,結合阿斯利康自有的基因組學、化學以及臨床數據與Benevolent AI靶點識別平臺和生物醫學知識圖譜,對治療慢性腎病和特發性肺纖維化疾病方面的藥物進行新藥研發。該合作在2021年1月27日取得了階段性的成功,阿斯利康在Benevolent AI的人工智能技術幫助下,在導致慢性腎病的潛在細胞機制中,成功發現了新的額藥物靶點,并已將該靶點納入其公司藥物開發計劃,準備進一步的藥物研發。
目前,Benevolent AI藥物研發項目主要涵蓋過敏性皮膚炎、肌萎縮性脊髓側索硬化癥、潰瘍性結腸炎、炎癥性腸病、中樞神經系統疾病、膠質母細胞瘤、非酒精性脂肪肝,同阿斯利康合作的慢性腎病、特發性肺纖維化疾病以及20多個早期藥物靶點探究。其中,通過其人工智能平臺研發治療過敏性皮膚炎的藥物BEN-2293已經進入I期臨床試驗,該藥物被視作是一款best-in-class、通過AI技術研發的多靶點小分子Pan-Trk拮抗劑。
4. 挑戰和思考
AI在藥物發現中的挑戰
盡管人工智能在藥物發現方面顯示出了巨大的希望,但并非沒有挑戰。 AI面臨著數據缺失、互操作性缺失等諸多挑戰。
在所有實施人工智能的行業中,缺乏數據是一個反復出現的問題。在傳統的生物學研究中,有效樣本的數量有限。 然而大多數機器學習算法必須在成百上千的數據點或樣本上進行訓練才能表現良好。另一個挑戰是缺乏可解釋性。通常很難解釋模型如何進行某些預測和執行。更可能發生在深度學習中,其中每一層都增加了模型的復雜性。隨著層數的增加,對每一層輸出的解釋可能會變得指數級復雜。
使用人工智能預測藥物靶點的另一個障礙仍然是將全球實驗室進行的傳統基礎研究翻譯成計算機可以理解的語言。機器學習程序依賴于以可以識別模式并可以訓練機器的格式呈現的數據。這通常需要復雜的實驗設計,將人為錯誤保持在最低限度,并且可以在幾乎相同的條件下執行多次不同的實驗迭代。
機器學習算法將數據轉換為通路檢測、3D 蛋白質結構、代謝物質量測量等。這些 AI 轉換可以以前所未有的速度發生。然而,在許多情況下,所使用的數據質量不佳(例如圖像分辨率)或不平衡(即來自罕見疾病的樣本在數據集中代表性不足)。
與任何給我們對現有技術的理解帶來范式轉變的進步一樣,人工智能仍然無法在藥物發現過程中完全取代人類科學家。最終,計算機的預測必須經過科學家的驗證,以確保人工智能在藥物研發在的有效性和實用性。
思考與未來
人工智能技術在新藥研發中有巨大的前景,而且有些技術已經取得了階段性的進展,AI協助研發出來的新藥也已經進入臨床,不少AI醫藥研發公司也在不斷的取得新的成果。但是,AI技術在醫藥研發上若要取得井噴性和長期有效的成果,還需要有更大的改善和發展。
人工智能技術在新藥研發的應用是一項跨學科,跨行業的合作,極需具備精通人工智能技術及生物制藥技術的復合型人才, 也需要IT行業與醫藥行業,學校及科研機構與醫藥公司的通力合作。國際制藥大公司可以通過其雄厚的研發力量在這方面取得成果。中小型的醫藥研發公司也可以找準目標,確定突破口,同時積累人才,做好轉型轉化的工作,取得快速有成效的成果。
人工智能技術在新藥研發要取得持久的研發成果和商業價值,也需要醫藥公司與投資行業的緊密合作。 只有大規模的投資進入這個領域,營造出良好的行業狀態和環境,才能使人工智能技術在新藥研發從初期的探索,走向中期大規模產品進入臨床試驗,最終產品進入商業市場,為患者快速帶來急需的醫藥產品,為研發者和投資者帶來回報。
參考資料:
1. Ke, Y.-Y., Peng, T.-T., Yeh, T.-K., Huang, W.-Z., Chang, S.-E., Wu, S.-H., Hung, H.-C., Hsu, T.-A., Lee, S.-J., Song, J.-S., 2020. Artificial intelligence approach fighting COVID-19 with repurposing drugs. Biomed. J. https://doi.org/10.1016/ j.bj.2020.05.001.
2. 德勤(2020),“十四五”規劃的思考. https://www2.deloitte.com/content/dam/Deloitte/cn/Documents/ser-soe-br/deloitte-cn-fourteenth-five-year-plan-report-zh-200521.pdf
3. 工聯網,中國信通院解讀:“十四五”規劃人工智能三大布局,2021.03.17. http://www.cww.net.cn/article?id=484079
4. 德勤(2020),“十四五”規劃的思考. https://www2.deloitte.com/content/dam/Deloitte/cn/Documents/ser-soe-br/deloitte-cn-fourteenth-five-year-plan-report-zh-200521.pdf.
5. Paul, Debleena et al. “Artificial intelligence in drug discovery and development.” Drug discovery today vol. 26,1 (2021): 80-93. doi:10.1016/j.drudis.2020.10.010
6. https://www2.deloitte.com/content/dam/insights/us/articles/32961_intelligent-drug-discovery/DI_Intelligent-Drug-Discovery.pdf
7. Claudio N. Cavasotto, Juan I. Di Filippo, Artificial intelligence in the early stages of drug discovery, Archives of Biochemistry and Biophysics, Volume 698, 2021, 108730, ISSN 0003-9861,
8. https://doi.org/10.1016/j.abb.2020.108730.
9. Debleena Paul, Rakesh K. Tekade, et al. Artificial intelligence in drug discovery and development, Drug Discovery Today, Volume 26, Issue 1, 2021, Pages 80-93, ISSN 1359-6446, https://doi.org/10.1016/j.drudis.2020.10.010.
10. http://stcsm.sh.gov.cn/xwzx/kjzl/20210112/fecb48d476b94fa4aca8798dd83db1b8.html
11. https://finance.sina.com.cn/chanjing/gsnews/2020-12-01/doc-iiznctke4188648.shtml
12. Liangliang Wang, Junjie Ding, Li Pan, Dongsheng Cao, Hui Jiang, Xiaoqin Ding, Artificial intelligence facilitates drug design in the big data era, Chemometrics and Intelligent Laboratory Systems, Volume 194, 2019, 103850, ISSN 0169-7439, https://doi.org/10.1016/j.chemolab.2019.103850.
13. M. Spencer, J. Eickholt, J.L. Cheng, A deep learning network approach to ab initio protein secondary structure prediction, IEEE/ACM Trans. Comput. Biol., 12 (2015), pp. 103-112, https://doi.org/10.1109/tcbb.2014.2343960.
14. Wang, S., Peng, J., Ma, J. et al. Protein Secondary Structure Prediction Using Deep Convolutional Neural Fields. Sci Rep 6, 18962 (2016). https://doi.org/10.1038/srep18962
15. Nature, “It will change everything’: DeepMind’s AI makes gigantic leap in solving protein structures”, 30 November 2020, https://www.nature.com/articles/d41586-020-03348-4
16. Debleena Paul, Rakesh K. Tekade, et al. Artificial intelligence in drug discovery and development, Drug Discovery Today, Volume 26, Issue 1, 2021, Pages 80-93, ISSN 1359-6446, https://doi.org/10.1016/j.drudis.2020.10.010.
17. Sangsoo Lim, Yijingxiu Lu, et al. A review on compound-protein interaction prediction mehods: Data, format, representation and model, Computational and Structural Biotechnology Journal, Volume 19, 2021, Pages 1541-1556, ISSN 2001-0370, https://doi.org/10.1016/j.csbj.2021.03.004.
18. Wang, F. et al. (2011) Computational screening for active compounds targeting protein sequences: methodology and experimental validation. J. Chem. Inf. Model. 51, 2821–2828
19. J. Med. Chem. 2020, 63, 16, 8667–8682 Publication Date: April 3, 2020 https://doi.org/10.1021/acs.jmedchem.9b02120
20. Zhou Y, Wang F, Tang J, Nussinov R, Cheng F. Artificial intelligence in COVID-19 drug repurposing. Lancet Digit Health. 2020 Dec;2(12):e667-e676. doi: 10.1016/S2589-7500(20)30192-8. Epub 2020 Sep 18. PMID: 32984792; PMCID: PMC7500917.
21. Kettle JG, Wilson DM. Standing on the shoulders of giants: a retrospective analysis of kinase drug discovery at AstraZeneca. Drug Discov Today. 2016 Oct;21(10):1596-1608. doi: 10.1016/j.drudis.2016.06.007. Epub 2016 Jun 15. PMID: 27319293.
22. Liangliang Wang, Junjie Ding, Li Pan, Dongsheng Cao, Hui Jiang, Xiaoqin Ding, Artificial intelligence facilitates drug design in the big data era, Chemometrics and Intelligent Laboratory Systems, Volume 194, 2019, 103850, ISSN 0169-7439, https://doi.org/10.1016/j.chemolab.2019.103850.
23. Rodriguez, S., Hug, C., Todorov, P. et al. Machine learning identifies candidates for drug repurposing in Alzheimer’s disease. Nat Commun 12, 1033 (2021). https://doi.org/10.1038/s41467-021-21330-0
24. Zhou Y, Wang F, Tang J, Nussinov R, Cheng F. Artificial intelligence in COVID-19 drug repurposing. Lancet Digit Health. 2020 Dec;2(12):e667-e676. doi: 10.1016/S2589-7500(20)30192-8. Epub 2020 Sep 18. PMID: 32984792; PMCID: PMC7500917.
25. https://www.tandfonline.com/doi/full/10.1080/17460441.2020.1767063
26. Lee K, Lee M, Kim D. Utilizing random Forest QSAR models with optimized parameters for target identification and its application to target-fishing server. BMC Bioinformatics. 2017 Dec 28;18(Suppl 16):567. PubMed PMID: 29297315; PubMed Central PMCID: PMCPMC5751401.
27. https://www.nature.com/articles/d43747-020-01098-w
28. Liangliang Wang, Junjie Ding, Li Pan, Dongsheng Cao, Hui Jiang, Xiaoqin Ding, Artificial intelligence facilitates drug design in the big data era, Chemometrics and Intelligent Laboratory Systems, Volume 194, 2019, 103850, ISSN 0169-7439, https://doi.org/10.1016/j.chemolab.2019.103850.
29. https://www.medchemexpress.cn/virtual-screening.html
30. https://www.biopharmatrend.com/m/companies/ai/
31. https://www.biopharmatrend.com/post/34-biopharmas-hunt-for-artificial-intelligence-who-does-what/
32. https://www.fiercebiotech.com/medtech/gsk-exscientia-ink-ai-based-drug-discovery-deal-worth-up-to-42m
33. https://media.bayer.com/baynews/baynews.nsf/id/Bayer-Exscientia-collaborate-leverage-potential-artificial-intelligence-cardiovascular-oncology
34. https://www.exscientia.ai/news-insights/sumitomo-dainippon-pharma-and-exscientia-joint-development
35. https://www.exscientia.ai/news-insights/aacr-presentation-exs21546-non-cns-penetrant-a2ar-selective-antagonist
36. https://www.exscientia.ai/news-insights/exscientia-first-ai-designed-immuno-oncology-drug-trial
37. https://www.benevolent.com/what-we-do
38. https://www.astrazeneca.com/media-centre/press-releases/2019/astrazeneca-starts-artificial-intelligence-collaboration-to-accelerate-drug-discovery-30042019.html
39. https://www.prnewswire.com/news-releases/benevolentai-and-astrazeneca-achieve-collaboration-milestone-with-novel-ai-generated-chronic-kidney-disease-target-301215406.html
40. https://www.benevolent.com/benevolentai-drug-programmes
42. https://roboticsbiz.com/ai-in-drug-discovery-benefits-drawback-and-challenges/